scientific literature
衰老作为肿瘤发生与进展的关键因素,在老年人群中,肿瘤发病率的攀升与免疫功能的减退呈现出明显的同步趋势。
众所周知,CD8+ T细胞在抗肿瘤免疫过程中占据着举足轻重的地位。然而,目前对于年龄因素引发的T细胞功能失调如何影响肿瘤的控制以及免疫治疗的效果,我们的了解仍然相对有限。
2024年5月,美国哈佛大学医学院的Debattama R. Sen教授团队在《Nature Immunology》杂志上发表了一篇题为“The aged tumor microenvironment limits T cell control of cancer”的研究论文。该研究揭示了衰老会削弱CD8 + T细胞在抗肿瘤过程中的功效,从而加速肿瘤的发展进程。

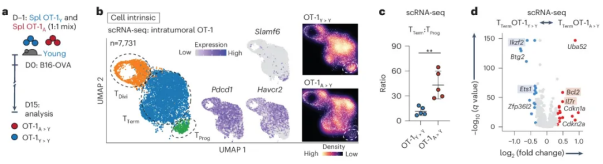
经过深入的研究分析,科研人员对小鼠T细胞衰老的特征进行了系统的探讨。研究结果表明,在衰老进程中,幼稚T细胞的数量呈现出相对减少的趋势,而PD-1+TIM-3+CD8+T细胞则呈现出增加的态势。值得一提的是,这些表型变化在小鼠年龄介于65至75周(相当于人类年龄的50至58岁)时,呈现出了急剧增加的趋势。这一发现为我们深入理解T细胞衰老的生物学过程提供了重要的线索。
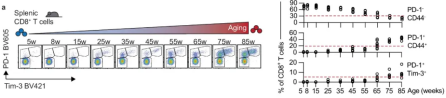
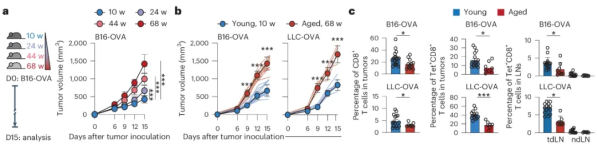
在后续的实验中,研究人员将B16-OVA(黑色素瘤细胞)细胞植入年龄介于10至68周的C57BL/6J小鼠体内,经过细致观察和分析,他们发现衰老与肿瘤生长的显著加速之间存在密切关联。
随后,为了更深入地探讨衰老对肿瘤生长的影响,研究人员进一步将B16-OVA或LLC-OVA细胞(即表达OVA的Lewis肺癌细胞)分别植入年轻(10-12周)和老年(68-70周)小鼠体内。经过对比实验,他们发现老年小鼠体内的肿瘤生长速度相较于年轻小鼠更为迅速,同时老年小鼠体内的肿瘤浸润CD8+ T细胞数量明显减少。此外,研究结果还显示,在老年小鼠的肿瘤及肿瘤引流淋巴结内,OVA特异性CD8+ T细胞的数量也呈现出下降趋势。
综上所述,这些数据为衰老对肿瘤控制的负面影响提供了有力证据,并进一步揭示了衰老广泛改变了CD8+ T细胞的命运和功能。
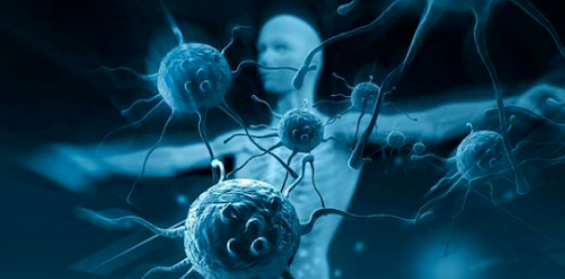
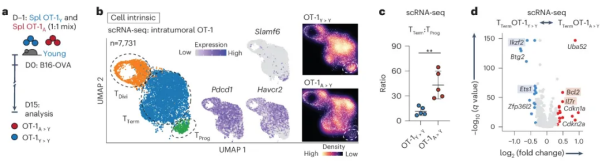
紧接着,研究人员想知道在肿瘤浸润性CD8+ T细胞中观察到的年龄相关变化是否可以仅仅用健康老年小鼠的基线T细胞内在缺陷来解释。为此,研究人员将遗传标记的CD45.1/CD45.2年轻的OT-1 (OT-1Y > Y)和CD45.1年老的OT-1 (OT-1A > Y) CD8+ T细胞共同转移到年轻的野生型(CD45.2)肿瘤小鼠中,并在15天后通过scRNA-seq分析肿瘤浸润转移的T细胞。
结果发现了三个主要的亚群,包括T Prog和T Term细胞的已知亚群,这是由它们独特的基因特征定义的。此外,衰老的OT-1(A > Y )T细胞中T Term细胞与T Prog细胞的比例远高于OT-1(Y > Y) T细胞。衰老的 OT-1 (A > Y )T Term细胞表达的Ikzf2较少,细胞周期抑制剂(如Cdkn1a和Cdkn2a )的表达较高。这表明衰老过程中的 CD8 + T 细胞功能障碍至少部分内在印记在 CD8+ T 细胞内。
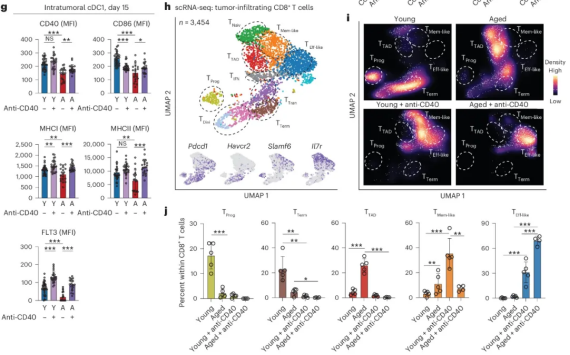
经过深入研究,我们发现衰老肿瘤免疫微环境的改变对自然杀伤细胞(NK)与树突状细胞(DC)以及CD8+ T细胞之间的相互作用造成了损害,进而导致了传统1型树突状细胞(cDC1s)对CD8+ T细胞的启动能力降低。由于这些缺陷的存在,年老荷瘤小鼠无法从治疗性mRNA疫苗接种中获得预期的治疗效益。最终,我们的研究团队发现,骨髓靶向免疫疗法能够激活cDC1s,从而改善老年小鼠的肿瘤控制效果,并显著增强CD8+ T细胞的免疫应答能力。
综上所述,本研究揭示了衰老过程中肿瘤生长加速的现象与 CD8 + T 细胞浸润及功能下降之间存在密切关联。值得注意的是,由于 T 细胞功能障碍的快速诱导,从年轻小鼠移植的 T 细胞并不能有效恢复老年小鼠的肿瘤控制。
此外,本研究还发现,在衰老肿瘤微环境中,NK-DC1-CD8 + T 细胞交互的改变会损害 cDC1 的 T 细胞启动功能,并促进 T TAD 细胞的形成。然而,通过针对骨髓的治疗手段,可以重新激活传统的 1 型树突状细胞,进而改善肿瘤控制,并恢复衰老过程中的 CD8 + T 细胞免疫功能。